KIST 류주희 박사팀, 1조원대 시장 대체 가능성
항암치료, 패러다임이 바뀐다. 자료사진.
[아시아경제 김봉수 기자] 현재 1조원대 규모로 시판되는 항암 치료제를 개선해 부작용을 없애고 효과는 더 강화한 항암 치료물질이 국내 연구진에 의해 개발됐다. 기존 물질을 활용한 것이어서 임상 및 상용화도 한결 손쉬워 주목된다.
한국과학기술연구원(KIST)는 테라그노시스연구센터 류주희(아래 사진) 박사 연구팀이 면역세포를 포함한 정상 세포에 미치는 독성은 최소화하면서 암세포에만 반응하여 암세포를 죽이고, 환자의 면역상태를 높여 항암 면역치료에 도움을 줄 수 있는 항암 전구체 약물을 개발했다고 30일 밝혔다.
암세포를 직접 공격하여 죽이는 기존의 암 치료법과는 달리, 몸속의 면역력을 강화해 암세포를 죽이는 항암 면역치료는 최근 들어 주목받고 있는 새로운 방식의 암 치료법이다. 하지만 기본 면역능력이 좋은 20% 정도의 환자에게서만 효과를 기대할 수 있어 대다수의 환자에게 적용할 수는 없는 현실이다.
특히 병원에서 암세포 치료 약물로 사용되고 있는 ‘독소루비신’은 최근 항암 효과 외에도 암세포가 죽으면서 방출되는 다양한 성분들로 인해 환자의 면역력이 높아질 수 있음이 알려져 있는 상태다. 하지만 독소루비신은 암세포 외에 정상 세포에도 독성과 염증반응을 일으킬 수 있고 특히 면역세포에도 독성을 보여 환자의 면역수준을 오히려 떨어트릴 수 있는 문제가 있었다.
센터는 지난해 이미 독소루비신 항암제의 내성을 억제하고 정상 세포와는 반응하지 않게 해 암세포만 죽일 수 있는 항암치료제를 개발한 바 있다. 연구팀은 이번에 독소루비신이 환자의 면역능력을 향상시킬 수 있다는 점에 착안해 연구한 결과 항암 면역 치료용으로 활용할 수 있는 약물을 개발했다.

개발한 약물은 독소루비신을 비활성화 시키는 펩타이드와 결합되어 약효나 독성을 나타내지 않는 상태로 있다가, 암세포에 다량 존재하는 효소에 의해 활성화되어 항암효능을 나타내게 된다. 따라서 정상 세포에서는 활성화되지 않아 독성 및 염증반응은 일어나지 않고 암세포에서는 활성화돼 독소루비신의 성분으로 인해 암세포를 죽이고, 환자의 면역 능력을 높여주므로 향후 활발한 항암 면역반응을 유도한다.
그 결과 개발된 항암 약물은 비임상 동물모델에서 항암 면역반응성을 크게 향상시켰고 정상조직에서의 부작용인 염증반응 및 독성이 크게 감소했다. 향후 항암치료 효과를 높이기 위해 해당 약물을 부작용 걱정 없이 더 높은 농도로 처리할 수 있을 것으로 보인다.
기존 임상에서 사용되고 있는 약물을 활용해 개발한 약물이므로 임상시험이 비교적 단순해 상용화 절차가 간단하다. 4개의 아미노산과 독소루비신이 결합한 간단한 화학구조로 인해 제조공정이 단순해 대량 생산이 용이하다. 따라서 약물의 임상 및 사업화를 고려한 약물의 제조 면에서 큰 이점을 가지고 있다.
류주희 박사는 “면역 치료제의 놀라운 치료 효과를 대다수 환자가 누리기 위해서는 적절한 환자들의 면역수준이 올라와야 하는데, 정상조직에서의 독성 및 염증반응을 줄이면서 약물의 항암 면역반응을 유지할 수 있는 항암 전구체 약물이 큰 기여를 할 수 있을 것”이라고 말했다.
이 연구 결과는 재료 및 바이오소재 분야의 국제학술지 ‘Biomaterials’ (IF:10.317, JCR 분야 상위 2.6%) 최신 호에 게재됐다.
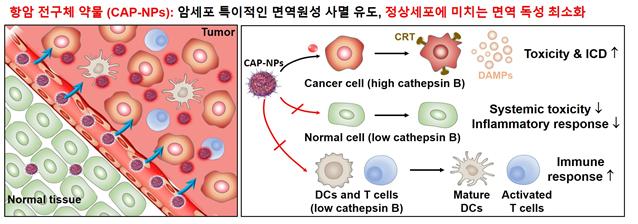
항암 전구체 약물은 EPR(Enhanced Permeability and Retention) 효과에 의해 종양 조직에 축적되며 암세포에서 과발현되는 카텝신B 효소에 의해 특이적으로 활성화되어 독소루비신을 방출한다. 종양 조직 내에서 종양 특이적으로 면역원성 세포사멸을 일으키며 면역세포에 대한 독성을 최소화하여 종양 조직 내 T 세포 등의 효과적인 성숙 및 활성화를 이룬다. 이와 동시에 정상 기관의 전신 독성 및 염증 반응을 현저히 감소시킨다. 그림제공=KIST
◇연구 배경
큰 관심을 받는 항암 면역 치료는 놀라운 효과를 보이고 있지만, 그 효과가 나타나는 환자의 수는 제한적이다. 내재 면역 능력이 좋은 암(hot tumor)에서 그렇지 않은 암(cold tumor)에 비해 치료 효과가 높게 나타난다고 알려져 있다. 따라서 암의 내재 면역 능력을 높여주는 것이 항암 면역치료에 있어서 매우 중요하게 여겨지고 있으며, 기존에 사용되고 있는 항암제 중에서 암세포의 면역원성 사멸을 유도할 수 있는 ’독소루비신’과 같은 화학 항암제가 새롭게 관심을 끌고 있다. 그러나 독소루비신은 암세포 외에 정상세포에 독성과 염증반응을 일으킬 수 있고, 특히 면역세포에 미치는 독성은 내재 면역 형성을 어렵게 한다. 이에 연구팀은 암세포에는 면역원성 사멸을 효과적으로 유도할 수 있으면서, 정상세포에는 독성 및 염증반응을 일으키지 않는 항암 전구체 약물을 개발했다.
◇연구내용
암세포 특이적 항암 전구체 약물은 기존의 항암제인 독소루비신을 암세포에 과량 존재하는 카텝신 B 효소에 의해 특이적 절단이 가능한 펩타이드를 통해 결합해 안정한 형태의 나노입자를 형성했다. 항암 전구체 약물은 암세포에서는 독소루비신으로 활성화돼 독소루비신과 비슷한 수준의 면역원성 사멸을 일으켜 암의 기초 면역 상태가 높은 암(hot tumor)이 되는 것을 세포 및 마우스 전임상 실험을 통해 확인할 수 있었다. 그러나 정상세포에서는 독소루비신으로 활성화되지 않는 상태로 존재해 면역원성 사멸을 일으키지 않았고, 이는 정상조직에서의 염증반응이 낮아진 결과로 이어졌다. 염증 관련 수용체인 Toll-like receptor 4(TLR-4)의 발현이 낮아지고 혈액에서의 TNF-α 및 IL-6의 양이 낮아진 것이다. 면역 치료제인 PD-L1 항체와의 병합 치료에서도 항암 전구체 약물은 강력한 암 억제능 및 높은 생존율을 나타냈다.
연구팀은 암세포 특이적 항암 전구체 약물이 기존에 알려진 화학요법 치료뿐 아니라 면역원성 사멸 유도를 통한 항암 면역요법 치료가 가능한 것을 세포 및 마우스 전임상 실험을 통해 입증했다. 항암 전구체 약물의 정상 세포에서의 낮은 독성과 염증 유도 반응은 면역 부작용에 대한 염려를 불식시켰다. 단독 치료제의 가능성 뿐만 아니라 다양한 면역 관용 억제제와의 병합 치료제로서의 가능성을 기대하고 있다.
암세포 / 사진=아시아경제 DB
다음은 연구 결과 문답이다.
◇연구를 시작한 계기나 배경은?
기존에 널리 사용되고 있는 화학요법 항암제 중에서 ’독소루비신’은 면역원성 사멸을 유도함으로써 항암 면역치료가 가능함이 알려졌다. 그러나 화학요법 항암제가 가지고 있는 정상 세포에서의 염증반응 유도로 인한 부작용으로 인해 사용에 제한이 있다. 또한 다양한 면역 치료제가 개발되고 있지만, 그 가격이 매우 비싸서 암 환자들이 사용하기에는 어려움이 많은 것도 본 연구를 시작한 계기가 되었다.
◇이번 성과, 무엇이 다른가?
항암 전구체 약물이 일반 약물에 비해 정상조직에서 염증반응을 저해하는 것을 Toll-like receptor 4와 같은 염증 유발과 관련된 수용체 발현의 감소 데이터와 혈액에서의 TNF-α 및 IL-6의 양 감소 데이터를 통해 직접적으로 보여주었다. 즉, 암세포 특이적 항암 전구체 약물은 암세포에 면역원성 사멸을 유도해 항암 면역치료를 유발할 뿐만 아니라, 정상 세포에서의 면역 부작용을 감소시켰다.
◇실용화된다면 어떻게 활용될 수 있나?
항암 전구체 약물의 유용성분인 독소루비신은 이미 임상에서 약 18종의 암에 사용되고 있다. 항암 전구체 약물의 정상조직에서의 낮은 독성과 염증 반응성은 전구체 약물의 사용 가능한 복용량을 높일 수 있어서, 더욱 다양한 암종으로의 사용 가능성을 보여준다고 할 수 있다. 상대적으로 대량 생산이 용이하고 약물 제조의 비용이 매우 저렴하여 임상 적용 가능성이 크다는 장점이 있다.
◇ 기대효과와 실용화를 위한 과제는?
가장 유사한 기술의 경쟁 상품이라 할 수 있는 독소루비신의 리포좀 나노제형인 DOXIL®은 약 1조원의 매출을 기록하는 블록버스터 약물이다. 이를 대체할 수 있는 항암제를 개발하기 위해 많은 연구자가 다양한 시도를 했지만, 다양한 기술적/산업적 문제로 인해 실제로 임상에서 사용할 수 있는 대체 약물은 개발되지 않았다. 전구체 약물의 기술적 우위성을 기반으로 실제 임상에 적용할 수 있다면 기존 독소루비신 시장인 1조원을 대체할 수 있을 것으로 기대한다. 이를 위해서는 항암제 자체의 효과 및 독성과 같은 기술적인 부분뿐만 아니라, 실제 생산을 하고 임상에 적용하였을 때 발생할 수 있는 산업적인 측면에서의 고려도 필요하다.
광주·전남 암환자가 늘고 있다. 특히 최근엔 대장암이 급격히 늘어나는 추세를 보이고 있다. 대장암 수술중인 의료진.
◇ 용어 설명
1. 카텝신 B (Cathepsin B)
리소솜(Lysosome)에 존재하는 산성의 단백질가수분해효소 중 하나이다. 카텝신B는 주로 세포의 이동, 분화, 증식 및 전이 등에 관여하는 것으로 알려져 있다. 특히, 이러한 현상이 활발히 발생하는 암세포에서는 정상 세포에 비해 카텝신B의 발현이 상대적으로 매우 높은 것으로 알려져 있다.
2. 면역원성 세포사멸 (immunogenic cell death)
면역원성 세포사멸(ICD)이란 세포 사멸 시에 체내 면역 시스템을 활성화하는 사멸의 한 형태로써, 수지상 세포와 같은 항원제시세포의 활성화와 그에 따른 특이적인 T 세포 반응의 활성화를 통해 효과적인 면역 시스템 자극을 유도한다.
3. 고온 종양 (hot tumor)
종양 미세환경은 면역 T 세포의 침투 정도에 따라 cold tumor 또는 hot tumor로 분류된다. 면역원성 종양을 가리키는 말로 면역세포 침윤이 부족한 cold tumor와 대비되어 쓰여진다. hot tumor는 종양 미세환경 내에 면역 T 세포가 충분하여 면역관문억제제의 반응률이 상대적으로 높아 면역 치료 반응률을 높이기 위해 cold tumor를 hot tumor로 바꾸는 연구가 진행되고 있다.
4. Toll-like receptor 4
Toll-like receptor 4는 선천면역을 활성화하는 주요 인자로 알려졌지만, 독소루비신에 의해 대식세포로의 Toll-like receptor 4의 상향조절은 독성 부작용을 생성하는 중요한 단계이기도 하다. 독소루비신에 의해 대식세포의 Toll-like receptor 4의 발현이 증가함으로써 전 염증성 사이토카인의 분비가 촉진된다.
5. 면역관문억제제 PD-L1 길항제
면역관문억제제는 면역계가 자가면역을 유지하고 면역반응을 조절하는 데 중요한 역할을 하는 다양한 억제 경로를 의미하며 종양세포는 면역관문억제제를 이용하여 면역세포의 공격을 무력화 시킨다. 면역체크포인트 길항제로 알려진 PD-L1 항체는 종양 세포막의 PD-L1 수용체에 결합하여 T 면역세포의 공격을 유도할 수 있다. Nivolumab, Pembrolizumab 등이 FDA에 승인을 받아 복합면역치료에 사용되고 있다.
김봉수 기자 bskim@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>