기존 표준치료제 '타그리소' 대비
비슷한 수준의 효능·안전성 확보
일부 고위험 환자군은 효능 향상
이번 주중 FDA 승인 여부 판가름
J&J "병용요법으로 年 7조 매출 기대"
유한양행 의 폐암 치료제 렉라자가 기존 글로벌 표준치료제 대비 뒤지지 않는 효능과 안정성을 입증하면서 글로벌 블록버스터 도약을 향한 기대감이 커지고 있다.
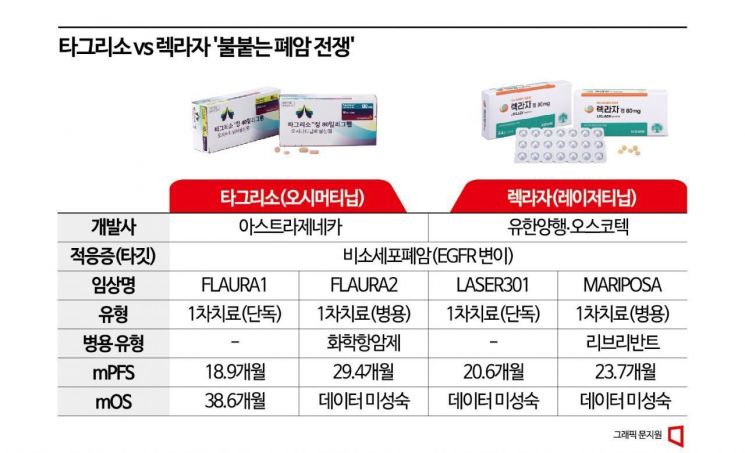
최근 공개된 세계폐암학회(WCLC 2024) 초록집에 따르면 렉라자는 현재 상피세포성장인자수용체(EGFR) 변이가 일어난 비소세포폐암 환자에게 가장 먼저 권장되는 치료법인 아스트라제네카(AZ)의 타그리소와 비교해 임상시험에서 비슷한 효능과 안전성을 확인했다. 이세훈 삼성서울병원 혈액종양내과 교수가 주도한 이번 연구는 다음 달 7~10일(현지시간) 미국 캘리포니아주 샌디에이고에서 열리는 WCLC 2024 행사 중 둘째 날인 8일 발표된다.
이번 연구는 글로벌 빅 파마 존슨앤드존슨(J&J)이 자사의 표적항체치료제 리브리반트와 렉라자를 함께 쓰기 위한 병용요법 임상시험인 '마리포사' 임상을 전향적으로 분석한 것이다. 마리포사 임상은 병용요법의 효능과 안전성을 타그리소와 비교하기 위한 연구다. 다만 여기서 J&J는 효능을 비교·분석하기 위한 대조군으로 타그리소 단독요법뿐만 아니라 렉라자 단독요법도 설정해 임상을 진행했다. 앞서 렉라자 단독요법은 허가용 임상시험에서 이전 세대 치료제인 이레사를 대조군으로 설정해 '현행' 표준치료법과의 비교가 어렵다는 지적을 받아왔는데 이를 극복할 수 있는 연구가 진행된 셈이다.
그 결과 이번 임상에서 항암제 효능 평가의 핵심 지표인 치료 후 암의 진행 또는 재발 없이 생존하는 기간(무진행생존기간)의 중앙값(mPFS)은 렉라자 단독요법이 18.5개월로 타그리소 단독군의 16.6개월보다 다소 앞섰다. 항암제가 효과를 나타낸 환자의 비율을 뜻하는 객관적 반응률(ORR)도 렉라자 83%, 타그리소 85%로 비슷했다. 두 약 간의 안전성도 유사한 것으로 확인되며 렉라자가 타그리소 대비 뒤지지 않는 효능과 안전성을 입증하게 됐다는 평가다.
특히 뇌전이나 또 다른 특수 변이가 나타나는 등의 일부 고위험 환자에게서는 렉라자가 더 좋은 효능을 보일 가능성도 제시됐다. 뇌 전이 병력이 있는 환자의 mPFS는 렉라자 16.4개월, 타그리소가 13개월로 렉라자가 더 진전된 효능을 나타냈다. TP53 변이 환자에게서도 렉라자는 mPFS 14.6개월로 타그리소(12.9개월)보다 좋은 효능을 확인했다.
특히 이번 초록 공개는 오는 22일(현지시간)로 예정된 렉라자·리브리반트 병용요법의 미국 식품의약국(FDA) 승인 여부 결정을 앞두고 나와 더 기대를 모은다. 병용요법은 마리포사 임상에서 타그리소 단독요법 대비 약 5개월 정도 늘어난 mPFS를 확보했다. FDA가 이 요법을 승인할 경우 렉라자는 국내에서 개발된 항암제 중 최초로 FDA 승인을 받은 약이 된다. 앞서 한미약품 의 롤론티스가 승인받기도 했지만 근본적 항암보다는 항암 부작용을 치료하는 약이고, HLB 의 리보세라닙은 도전장을 던졌지만 실패해 현재 재도전을 준비하고 있다.
승인이 성사될 경우 J&J는 렉라자를 이르면 연내 미국 시장에 출시할 계획이다. 2018년 12억5500만달러(약 1조7000억원)에 렉라자를 기술 도입한 J&J는 향후 두 약의 병용요법이 연간 50억달러(약 6조7725억원)의 매출을 올리는 블록버스터로 성장할 것으로 기대하고 있다.
이에 더해 추가 개발에도 박차를 가하고 있다. 현재 렉라자의 병용 파트너인 리브리반트는 정맥주사 제형으로만 개발돼있다. 정맥주사는 장시간 병원에서 머무르면서 맞아야 해 환자의 불편함이 크고, 의료기관에서도 각종 설비를 갖춰야 하는 부담이 있다. 이에 J&J는 리브리반트를 외래진료실에서 바로 맞을 수 있는 피하주사 제형을 개발, 현재 FDA 승인을 추진하고 있다.
이춘희 기자 spring@asiae.co.kr
꼭 봐야할 주요뉴스
 6000명 잘려나간다…"요즘 누가 먹어요" Z세대가 ...
마스크영역
6000명 잘려나간다…"요즘 누가 먹어요" Z세대가 ...
마스크영역
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>



![유한양행의 폐암 치료제 '렉라자'[사진제공=유한양행]](https://cphoto.asiae.co.kr/listimglink/1/2021070117164916050_1672673008.jpg)



![오입금 된 비트코인 팔아 빚 갚고 유흥비 쓴 이용자…2021년 대법원 판단은[리걸 이슈체크]](https://cwcontent.asiae.co.kr/asiaresize/269/2026020910431234020_1770601391.png)
!["세 낀 집, 8억에 나왔어요" 드디어 다주택자 움직이나…실거주 유예에 기대감[부동산AtoZ]](https://cwcontent.asiae.co.kr/asiaresize/269/2026020509352029563_1770251720.jpg)











![[서용석의 퓨처웨이브]'도구'가 아니라 '존재'임을 선언하는 AI](https://cwcontent.asiae.co.kr/asiaresize/269/2026021210480619240A.jpg)
![[초동시각]지역의사 10년 '유배' 아닌 '사명' 되려면](https://cwcontent.asiae.co.kr/asiaresize/269/2026021210225661581A.jpg)
![[기자수첩]개성공단 '보상'과 '지원'의 간극](https://cwcontent.asiae.co.kr/asiaresize/269/2026021210430293507A.jpg)


 가장 많이 읽힌 뉴스를 제공합니다. 집계 기준에 따라 최대 3일 전 기사까지 제공될 수 있습니다.
가장 많이 읽힌 뉴스를 제공합니다. 집계 기준에 따라 최대 3일 전 기사까지 제공될 수 있습니다.









