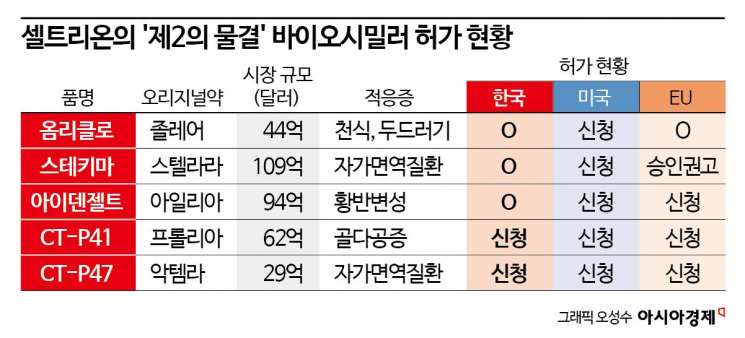
셀트리온 은 골다공증 치료제 프롤리아의 바이오시밀러로 개발한 CT-P41의 유효성 및 안전성을 분석한 글로벌 임상 3상 결과가 저명 국제 저널에 게재됐다고 6일 밝혔다. 해당 연구 결과는 국제골다공증재단(IOF)과 뼈건강및골다공증재단(BHOF) 공식 저널인 국제 골다공증을 통해 공개됐다.
셀트리온은 유럽 4개국에서 폐경 후 골다공증이 있는 여성 환자 479명을 대상으로 진행한 CT-P41의 글로벌 임상 3상을 통해 CT-P41과 오리지널 의약품 간 유효성, 약력학, 약동학 및 면역원성을 포함한 안전성을 비교했다.
이번에 발표된 연구 결과는 글로벌 임상 3상에 대한 78주간 평가에 대한 내용으로 CT-P41과 오리지널 의약품 투여군 간의 1차 유효성 및 약력학 평가지표가 모두 동등성 기준에 부합했고 오리지널 의약품 투여 후 52주 차에 CT-P41을 투여받은 환자군에서도 유효성과 안전성이 확인됐다는 내용이 담겼다.
상세 결과로 먼저 CT-P41 투여군과 오리지널 의약품 투여군으로 각각 나눠 베이스라인 대비 52주 차까지의 허리뼈 골밀도 변화량을 1차 평가지표로 측정했다. 측정 결과 두 그룹 간 차이가 사전에 정의한 동등성 기준에 부합했다. 또한 약력학적 1차 평가 변수인 골대사 주요 지표인 골 흡수 표지자(s-CTX)의 첫 6개월간 효과 곡선 아래 면적(AUC) 평가에서도 CT-P41과 오리지널 의약품 투여군 간의 동등성을 입증했다.
아울러 52주 차에 오리지널 의약품에서 CT-P41로 전환한 투약군과 78주 동안 CT-P41 또는 오리지널 의약품 투여를 유지한 투약군까지 총 3개 군을 비교했을 때 52주 차에 오리지널 의약품에서 CT-P41로 전환한 투약군의 유효성, 약력학, 약동학, 안전성 평가 결과도 유사했음을 확인했다.
프롤리아는 골다공증 치료제로 동일한 주성분이 암 환자의 골 전이 합병증을 예방 치료하는 엑스지바라는 제품명으로도 허가돼 있다. 지난해 글로벌 매출은 61억6000만달러(약 8조원)를 기록했다.
셀트리온 관계자는 “이번 발표를 통해 오리지널 의약품 대비 CT-P41의 유효성과 안전성을 재확인한 만큼 글로벌 주요 국가에 진행 중인 허가도 차질 없이 진행될 수 있도록 최선을 다하겠다”며 “기존에 강점을 가진 자가면역질환 치료제와 항암제에 이어 골 질환, 안질환, 알레르기 질환 등 다양한 분야의 치료제 포트폴리오를 빠르게 확대해 성장의 속도도 올리겠다”고 말했다.
셀트리온은 최근 옴리클로(졸레어 바이오시밀러), 스테키마(스텔라라 바이오시밀러), 아이덴젤트(아일리아 바이오시밀러) 등 후속 파이프라인의 품목허가를 잇달아 획득하며 글로벌 시장 지배력 강화와 매출 확대에 속도를 내고 있다.
이춘희 기자 spring@asiae.co.kr
꼭 봐야할 주요뉴스
!["뭐야?" 삼성전자도 뜬금없는 하한가… 눈 빠져라 출퇴근길 '주식창' 보며 전전긍긍[넥스트레이드 1년]②](https://cwcontent.asiae.co.kr/asiaresize/93/2026030309533058917_1772499210.png) "뭐야?" 삼성전자도 뜬금없는 하한가… 눈 빠져라 ...
마스크영역
"뭐야?" 삼성전자도 뜬금없는 하한가… 눈 빠져라 ...
마스크영역
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>



![암젠의 골다공증 치료제 '프롤리아'[사진제공=암젠]](https://cphoto.asiae.co.kr/listimglink/1/2023122916113313902_1703833893.png)

















![[산업의 맥]실종된 패러다임…난무하는 정책](https://cwcontent.asiae.co.kr/asiaresize/269/2026030313322105393A.jpg)
![[시론]100만 '일잘하는 공무원'을 육성하자](https://cwcontent.asiae.co.kr/asiaresize/269/2026030313235864161A.jpg)
![[기자수첩]6000피 축제, 100원 전쟁](https://cwcontent.asiae.co.kr/asiaresize/269/2026030309490374205A.jpg)


 가장 많이 읽힌 뉴스를 제공합니다. 집계 기준에 따라 최대 3일 전 기사까지 제공될 수 있습니다.
가장 많이 읽힌 뉴스를 제공합니다. 집계 기준에 따라 최대 3일 전 기사까지 제공될 수 있습니다.






![[으라車車]새 차 첨단 기능에 지갑 탈탈…편의·안전성에 그저 구독 꾹꾹](https://cwcontent.asiae.co.kr/asiaresize/210/2026022709474455509_1772153264.png)